肺癌早期诊断与筛查技术比较、指南推荐及未来展望的综合报告
1. 引言: 肺癌早期检测的迫切性
1.1. 肺癌的全球负担与早期检测的意义
肺癌是全球范围内导致癌症相关死亡的主要原因之一,其高死亡率往往归因于诊断时已届晚期,此时根治性治疗方案选择有限。大量研究证实,早期发现能够显著提高患者的生存率。例如,I 期肺癌患者的预后远优于晚期患者。因此,开发并应用有效的早期诊断和筛查策略,将肺癌的发现时点向更早、更易治疗的阶段推移,是当前肿瘤学领域面临的关键挑战与迫切需求。
1.2. 当前与新兴诊断及筛查模式概述
肺癌的早期检测技术经历了从传统影像学方法(如胸部X光片)到目前公认标准的低剂量计算机断层扫描(LDCT)的演进。然而,现有技术并非完美,仍在不断探索更精准、创伤更小、成本效益更高的解决方案。本报告将系统比较目前临床常用的肺癌早期诊断与筛查技术手段,包括LDCT、胸部X光片(CXR)、痰液细胞学检查、支气管镜检查,以及近年来备受关注的新兴技术,如液体活检(包括循环肿瘤DNA(ctDNA)、循环肿瘤细胞(CTCS)和外泌体)、呼出气体挥发性有机化合物(VOCs)分析,并探讨人工智能(AI)和多组学技术在这一领域的应用前景。
肺癌早期检测领域存在一个显著的现象,即"早期检测悖论"。尽管早期发现对提高生存率至关重要,目前最成熟的筛查手段——LDCT——却伴随着假阳性率高和过度诊断等不容忽视的弊端。这一内在矛盾是驱动该领域技术创新的核心动力,促使研究者们积极探索如液体活检和VOCs分析等有望克服LDCT局限性的新型技术。LDCT因其高灵敏度能够发现微小结节,但肺内很多小结节并非恶性。在筛查的高危人群中,肺癌的实际患病率相对较低(例如,NLST研究中LDCT 组的癌症诊断率约为1.1%),这意味着大量由LDCT检出的"阳性"信号(即肺结节)最终被证实为假阳性。这种高检出能力与相对较低的真实癌变率之间的不匹配,是导致高假阳性率的根本原因。
同时,"高危人群"的定义本身也在不断演化。最初的筛查指南严格依赖于年龄和重度吸烟史。然而,新近的指南和研究趋势显示,风险评估正逐渐纳入更多因素,例如较低的吸烟暴露量(包年数)、更长的戒烟年限(甚至无年限限制)、家族史以及职业暴露等。这种定义的扩展反映了对肺癌异质性认识的深化,也对筛查技术提出了在更广泛风险谱人群中保持有效性的要求,并对筛查项目的公共卫生影响、成本效益和公平性带来深远影响。
展望未来,单一技术不太可能解决所有问题。肺癌早期检测的趋势似乎是指向多种模式的智能化整合——结合影像学、分子生物标志物和人工智能,以构建个性化、多层级、更高效的筛查路径。例如,LDCT发现的肺结节,其良恶性鉴别可能受益于液体活检或VOCs分析等非侵入性手段的辅助,从而在进行有创活检前提供更多风险分层信息。AI则有望增强LDCT图像的解读准确性,并辅助分析复杂的生物标志物数据。这种多技术互补的策略,而非相互竞争,预示着未来筛查模式的演进方向。
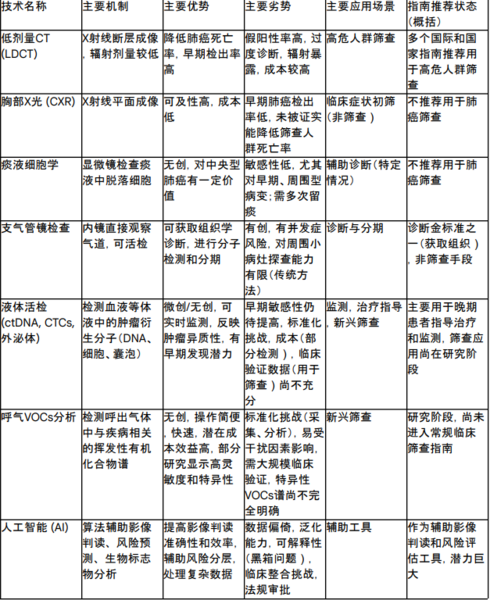
2. 肺癌的既有筛查与诊断方法
2.1. 低剂量计算机断层扫描(LDCT)
原理与机制
LDCT是一种利用X射线对肺部进行详细横断面成像的技术,其辐射剂量远低于标准胸部CT扫描。扫描过程快速且无痛。
优势
LDCT最显著的优势在于其已被多项大规模临床试验证实能够有效降低高危人群的肺癌死亡率。例如,欧洲的Nelson试验报道,LDCT筛查可使男性和女性的肺癌死亡率分别降低24%和高达33-59%(不同报道数据略有差异),而美国的国家肺癌筛查试验(NLST)显示死亡率降低了20%。LDCT能够有效地检测到体积较小、处于早期的肺癌病灶,此时治疗成功的可能性更大。DANTE和ITALUNG等研究也表明LDCT能检出更多早期病例。因此,LDCT是目前唯一被各大权威指南推荐用于高危人群肺癌筛查的技术。
局限性
尽管LDCT在降低死亡率方面效果显著,但其高灵敏度也带来了一系列问题。首先是假阳性率高。LDCT能够发现许多肺内小结节,但其中绝大多数并非恶性。NLST研究中,LDCT筛查的阳性预测值(PPV)仅为3.8%,意味着96.2%的阳性结果(检出结节)最终证实为假阳性。基线筛查时,NLST和NELSON研究的假阳性率分别报告为26.3%和19.8%。高达半数的受检者可能在首次筛查中检出一个或多个结节。这种高假阳性率直接导致了不必要的进一步检查(如重复CT扫描、PET扫描)和有创操作(如经皮肺穿刺活检甚至手术活检),增加了患者的经济负担、辐射暴露、潜在的并发症风险以及心理焦虑。
其次是过度诊断。LDCT可能检测到一些生长缓慢、惰性的肺癌,这些肿瘤在患者的自然生命周期内可能永远不会发展到产生临床症状或威胁生命的程度。然而,一旦检出,目前的医疗实践往往倾向于治疗,从而导致部分患者接受了不必要的治疗及其伴随的风险和副作用。
第三,辐射暴露也是一个顾虑。尽管单次LDCT的辐射剂量较低(约为每年自然本底辐射的一半,或标准CT的五分之一),但由于推荐进行年度筛查,累积的辐射暴露仍存在诱发癌症的微小理论风险。
此外,LDCT筛查的成本和可及性也限制了其广泛应用,它需要专门的扫描设备和经验丰富的影像科医师及多学科团队进行判读和后续管理。LDCT还可能发现肺部以外的偶然所见(inciDental findiNGS),如肺气肿、冠状动脉钙化等,这可能对患者健康管理有益,但也可能引发额外的检查和干预。
效能指标
根据NLST研究,LDCT筛查的敏感性为93.8%,特异性为73.4%。一项基于VGG16的卷积神经网络(CNN)模型在LDCT图像分析中表现出0.776的敏感性,0.962的特异性,0.868的PPV,0.931的阴性预测值(NPV),以及0.963的受试者工作特征曲线下面积(AUC)。
临床应用与当前角色
LDCT是目前指南推荐的对特定高危人群进行年度肺癌筛查的标准方法。筛查前强调医患共同决策,充分告知筛查的获益与风险,并结合戒烟咨询。筛查机构应具备相应的设备资质和多学科诊疗经验。对于筛查发现的肺结节,需根据其大小、密度、生长速度等特征,遵循相应的管理指南(如Lung-RADS或中国相关指南)进行随访或进一步诊断评估。
2.2. 胸部X光片(CXR)
历史背景与当前局限性
CXR曾是评估肺部病变的常用影像学手段。然而,多项大规模临床研究,包括梅奥肺癌筛查研究(Mayo Lung ProJect)和前列腺、肺、结直肠和卵巢癌筛查试验(PLCO),以及NLST研究的对照组数据,均未能证实CXR筛查可以降低肺癌死亡率。与CT相比,CXR提供的图像细节较少,对早期、微小病灶的敏感性不足。
比较效能与指南地位
由于缺乏降低死亡率的证据,当前主流指南均不推荐将CXR用于肺癌筛查。NLST研究中,CXR组的假阳性率据一项资料提及为94.5%。一般而言CXR假阳性率低于LDCT,但敏感性更低。CXR对于早期病变和小结节的检出能力不如CT。CXR在降低肺癌死亡率方面的无效性,使其成为了衡量LDCT筛查效果的重要历史参照。NLST等研究通过与CXR对比,才确立了LDCT的优越性。尽管CXR具有普及和价廉的优势,但其在早期肺癌检出上的不足,使其不适用于筛查,否则可能因漏诊而延误病情,或因假阳性造成不必要的恐慌和后续检查。
效能指标
传统CXR对早期肺癌的敏感性普遍较低。AI辅助的CXR判读系统在一些研究中显示出较高的敏感性(56.4-95.7%)和特异性(71.9-97.5%),AUC可达0.89-0.99,优于放射科医师的平均AUC(0.81)。但这反映的是AI增强后的性能,而非单独CXR的常规筛查效能。
2.3. 痰液细胞学检查
原理与效用
痰液细胞学检查是通过显微镜观察患者咳出的痰液样本中是否存在恶性肿瘤细胞。该方法对于起源于大气道中心部位的肺癌(如鳞状细胞癌)检出率相对较高。
早期检测的局限性
痰液细胞学检查不被推荐作为常规的肺癌筛查手段。其敏感性,特别是对于早期、周围型病变,通常较低。为了提高检出率,往往需要连续多日(如3天)采集清晨深咳痰样本。仅在其他诊断方法风险过高时,才可能考虑作为诊断辅助。
效能指标
痰液细胞学检查的效能指标变异较大。一项研究报告总体敏感性为58.8%,特异性为85.7%,PPV为83.3%,NPV为38%。另一项研究则显示敏感性为28.75%,特异性为100%,PPV为100%,NPV为31.58%。Schreiber (2003)引用敏感性为49%。对大于2 cm的病灶,检出敏感性有所提高。
临床应用
目前主要用于有症状或影像学有可疑发现患者的辅助诊断,尤其是当怀疑中央型病变或患者不适合进行支气管镜等有创检查时。不用于无症状人群的筛查。
2.4. 支气管镜检查
在诊断与分期中的角色
支气管镜检查是一种重要的有创检查手段,通过可弯曲或硬质的内镜直接观察气管和支气管腔内情况,并可获取组织样本进行病理学诊断及分子标志物检测,对于肺癌的诊断和分期至关重要。它并非筛查工具。
类型与进展
可弯曲支气管镜(Flexible Bronchoscopy):是标准检查方法,对中央型病变诊断敏感性可达88%,对周围型病变的总体敏感性约为78%(具体取决于活检技术和病灶大小、位置)。
针对早期/癌前病变的先进技术:
自体荧光支气管镜(AutofluoresCEnce Bronchoscopy,AFB)和窄带成像(NARrow Band Imaging,NBI):这些技术旨在提高对常规白光支气管镜(White Light Bronchoscopy,WLB)下难以发现的早期黏膜病变(如不典型增生、原位癌)的检出率。AFB联合WLB的敏感性高于单独WLB,但AFB的特异性较低,易产生假阳性(如炎症反应)。
基于探头的技术:如经支气管超声引导的放射状探头(Radial EBUS,R-EBUS)、光学相干断层扫描(Optical Coherence Tomography,OCT)、共聚焦激光显微内镜(Confocal Laser EndoMicroscopy,CLE)等,用于探查和指导活检周围型肺病变。
机器人辅助支气管镜(Robotic-ASSIsted Bronchoscopy,RAB):如Ion™系统,通过形状感应技术和可操控的导管,显著提升了对肺部外周微小结节的导航精度和活检成功率。研究显示其诊断率可达86.1-87.8%,优于传统的电磁导航支气管镜(ENB)。
经支气管超声(Endobronchial Ultrasound,EBUS):主要用于对纵隔和肺门淋巴结进行穿刺活检(EBUS-TBNA),是肺癌分期的关键技术。
快速现场评价(RapID On-Site Evaluation,ROSE):在支气管镜检查过程中,由细胞病理医师对获取的标本进行即时细胞学评估,以判断标本是否满意,从而提高诊断阳性率,减少不必要的重复取样或操作时间。ROSE在区分小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)方面显示出高准确性。
优势
支气管镜检查能够直接观察病灶并获取组织样本,为肺癌提供明确的病理诊断和分子分型信息,指导后续治疗。部分支气管镜技术还具备治疗功能,如肿瘤消融、支架置入等。
劣势
作为有创检查,支气管镜存在一定的并发症风险,尽管对于诊断性操作而言通常风险可控。常见风险包括出血、感染、喉痉挛、心律失常,以及与外周病灶活检相关的气胸风险。单独使用WLB可能会漏诊部分早期癌前病变或微小浸润癌。
效能指标
可弯曲支气管镜对中央型病变敏感性为88%。
对周围型病变总体敏感性为78%(范围36-88%)。作为参照,液体活检(ctDNA检测EGFR突变)的敏感性在59-70%之间(与组织活检金标准比较)。
单独WLB仅能检出29%的原位癌(CIS)和69%的微小浸润癌。
AFB+WLB联合使用较单独WLB有更高的敏感性(对上皮内瘤变的相对敏感性为2.04-6.3倍),但特异性较低。
ROSE对SCLC和NSCLC分类的准确性分别达到95.32%和92.45%。
临床应用
支气管镜主要用于对影像学检查(如CT)发现的可疑病灶进行调查,获取组织进行病理诊断和分子检测,以及进行肺癌的淋巴结分期和部分治疗性干预。
3. 肺癌早期检测的新兴技术
3.1. 液体活检(循环肿瘤DNA-ctDNA,循环肿瘤细胞-CTCs,外泌体)
原理与潜力
液体活检是一种通过分析体液(主要是血液,也包括尿液、唾液等)中肿瘤来源的生物标志物(如ctDNA、CTCs、外泌体等)来进行癌症检测、表征和监测的技术。它提供了一种微创或无创的方法,有望克服传统组织活检的局限性,如创伤性、难以重复取样以及难以全面反映肿瘤异质性等问题。
ctDNA:是由肿瘤细胞释放到血液循环中的DNA片段。这些DNA片段携带了肿瘤特有的基因突变、甲基化等表观遗传学改变信息。与正常细胞来源的游离DNA(cfDNA)相比,ctDNA的片段通常更短。
CTCs:是指从原发肿瘤或转移灶脱落并进入血液循环的完整肿瘤细胞。CTCs的存在与数量可能与肿瘤进展和预后相关。
外泌体:是由包括癌细胞在内的多种细胞分泌到细胞外的纳米级囊泡,其内部包裹着来源细胞的蛋白质、RNA(包括microRNA)、DNA等生物大分子,能够反映来源细胞的状态。外泌体中的miRNA等已被探索作为潜在的肺癌生物标志物。
优势
微创/无创性:主要通过简单的血液取样即可完成,对患者创伤小,易于接受。
实时监测与动态评估:ctDNA在血液中的半衰期较短,使得液体活检能够动态监测肿瘤负荷变化、评估治疗反应、早期发现耐药突变的出现以及预测复发风险,甚至可能比影像学更早发现疾病进展或复发。
克服肿瘤异质性:与单点组织活检相比,液体活检理论上能从血液中捕获来自肿瘤不同区域或不同转移灶的分子信息,从而更全面地反映肿瘤的整体异质性。
早期发现潜力:多项研究表明,ctDNA和CTCs在早期肺癌患者中即可被检测到。例如,有研究报道在II-IV期NSCLC患者中ctDNA检出率达100%,在I期NSCLC患者中检出率为50%。CTCs研究也显示其对预测第二原发肺癌有较高价值。
潜在成本效益:相较于有创的组织活检,液体活检的单次检测成本可能更低,尤其适合在资源相对匮乏的地区推广。
当前局限性与挑战
早期筛查的敏感性不足:这是液体活检应用于无症状人群早期筛查面临的最大挑战。早期肿瘤释放到血液中的ctDNA浓度极低,CTCs数量稀少,现有技术难以稳定、高灵敏地检出。
标准化程度不高:从样本采集、处理、保存到分析检测方法、数据解读等环节,目前尚缺乏统一的标准化流程和质控标准,这限制了不同研究结果的可比性和临床应用的推广。
生物学干扰:血液中存在大量来自正常细胞的cfDNA,以及与年龄相关的意义未明的克隆性造血(CHIP)等现象,都可能对ctDNA的检测和结果判读造成干扰,导致假阳性或假阴性。
CTCs和外泌体的分离与纯化技术挑战:CTCs在血液中极为罕见(约每10^9个血细胞中才有一个CTC),高效、高纯度地捕获和分离CTCs仍是技术难题。外泌体的分离同样面临纯度和产量的挑战。
临床验证尚不充分:尽管许多研究显示出液体活检的潜力,但在大规模、前瞻性的临床试验中验证其作为早期筛查工具的有效性和成本效益,仍是进行中的工作。
效能指标
ctDNA(用于EGFR等驱动基因突变检测,与组织活检对比):敏感性在不同研究和不同突变类型中有所差异,大致在60-84%(如针对Ex19del、L858R突变,使用PCR、ddPCR或NGS技术)。特异性通常较高,可达约98-99.8%。PPV约98.6%,NPV约93.8%。然而,ASSESS研究在真实世界多中心环境下评估ctDNA检测EGFR突变,总体敏感性未达到50%,凸显了标准化和高灵敏度方法的重要性。
Next Personal™ ctDNA检测分析:在一项验证研究中,其Lod95(95%检出限)为3.45 PPM(百万分之3.45),特异性报告为100%。
目前FDA批准的液体活检测试(如检测CTCs的CellSearch®,检测ctDNA的cobas® EGFR Mutation Test v2, Guardant360® CDx, FoundationOne® Liquid CDx等)主要用于转移性癌症患者的预后判断、治疗选择或疗效监测,而非用于无症状人群的早期筛查。
临床应用
当前,液体活检在临床上更多地应用于晚期肺癌患者,用以指导靶向治疗的选择(如检测EGFR、ALK、ROS1等基因突变或重排)、监测治疗反应、评估耐药机制的出现以及检测微小残留病(MRD)。其在肺癌早期发现和筛查领域的应用仍主要处于研究探索阶段,但发展迅速,被寄予厚望。
3.2. 呼出气体分析(挥发性有机化合物-VOCs)
科学基础与检测方法
肿瘤细胞由于代谢途径的改变,会产生并释放出特定的挥发性有机化合物(VOCs),这些VOCs可以通过呼吸排出体外,从而在呼出气体中形成独特的"气味指纹"或"化学图谱"。通过分析呼出气体中VOCs的组成和浓度差异,有望区分肺癌患者与健康人群。检测技术主要包括气相色谱-质谱联用(GC-MS)、电子鼻(e-noses)以及基于微机电系统(MEMS)的特种传感器等。
优势
完全无创与操作简便:仅需收集患者的呼出气体,过程简单、无痛、无辐射,患者依从性高。
快速获得结果:部分技术如电子鼻或集成了AI的MEMS传感器,可以在短时间内(如15分钟内)完成检测并给出结果。
较高的报告效能:一些系统综述和荟萃分析显示,VOCs检测肺癌具有较高的综合灵敏度(如85-87%)和特异性(如86-92%),AUC值可达0.93左右。
当前局限性与挑战
标准化问题突出:从呼气样本的采集(如呼吸方式、采集装置、环境控制)、预处理、储存到分析方法的选择、数据处理算法等,均缺乏统一的国际标准和操作规范,这是制约该技术临床转化的主要瓶颈之一。
结果的可重复性与验证:不同研究报告的VOCs标志物谱和诊断效能存在较大差异,许多研究结果难以在不同中心或人群中重复。迫切需要大规模、多中心的前瞻性临床试验来验证其真实世界的筛查效果。
易受混杂因素干扰:个体的饮食、吸烟习惯、用药情况、合并其他疾病(如COPD、哮喘)、环境暴露(如空气污染)等多种因素都可能影响呼出气体中VOCs的组成,从而干扰检测结果的准确性。
VOCs谱的复杂性与特异性:肺癌相关的VOCs标志物往往不是单一化合物,而是一个复杂的VOCs组合模式或"指纹"。准确识别并验证这些具有高特异性的VOCs谱,需要先进的分析技术和强大的人工智能算法支持。
技术成熟度与设备限制:尽管前景广阔,但许多新型传感器技术仍处于研发或早期临床测试阶段。传统的金标准方法GC-MS虽然精确,但设备昂贵、操作复杂、耗时较长,不适合作为一线筛查工具。
效能指标
一项包含25项研究的荟萃分析报告,呼气VOCs检测肺癌的综合灵敏度为85%,特异性为86%,AUC高达0.93。
另一项使用GC-IMS技术结合AI算法的研究,对所有分期肺癌的分类准确率为90%(灵敏度87%,特异性92%);对IA期早期肺癌的分类准确率亦为90%(灵敏度90%,特异性93%)。
还有研究引用了90%的灵敏度和83%的特异性数据。
临床应用
目前,呼气VOCs分析在肺癌筛查领域的应用仍处于研究阶段,尚未被主流临床指南推荐作为常规筛查方法。但其作为一种快速、无创的潜在初筛或辅助分流工具,展现出重要前景。
4. 人工智能(AI)的变革性作用
人工智能,特别是机器学习和深度学习,正在深刻影响肺癌早期检测的各个方面,它并非一种独立的筛查技术,而是赋能并提升现有及新兴技术效能的关键驱动力。
AI在增强LDCT判读中的应用
肺结节的检测与表征:AI算法,尤其是基于深度学习的计算机辅助检测/诊断(CAD/CADx)系统,能够显著提高LDCT乃至CXR图像上肺结节的检出率,包括那些微小、密度低或位置隐匿的结节。AI还能辅助评估结节的良恶性、测量大小、体积、密度、生长速度等关键参数。
降低假阳性率:通过更精准地鉴别恶性与良性结节,AI有望帮助减少LDCT筛查中常见的假阳性结果,从而降低不必要的随访检查和有创操作。
提升放射科医师工作效能:AI可作为"第二阅片者"或辅助工具,提高放射科医师(尤其是经验较少的医师)的诊断准确性和一致性,同时可能缩短阅片时间,减轻工作负荷。
效能表现:在图像分析任务中,AI系统常能达到甚至超越人类放射科医师的水平,尤其在敏感性方面,同时保持相当或更优的特异性和AUC值。例如,AI辅助CXR检出肺结节的敏感性可达56.4–95.7%,而放射科医师的敏感性范围较低;AI的AUC值在0.89–0.99之间,而放射科医师平均AUC为0.81。
AI在风险预测模型中的应用
AI被用于构建更复杂的肺癌风险预测模型,这些模型能够整合影像学特征(定量纹理分析、结节形态学参数等)、临床信息(如年龄、吸烟史、性别、合并症、家族史等)乃至基因组学数据,以实现对个体肺癌风险更精准的评估和分层。
例如,名为"Sybil"的深度学习模型,据报道能够仅通过一次基线LDCT扫描图像,独立于传统风险因素,预测长达6年的未来肺癌发生风险,即使在非吸烟人群中也显示出潜力。在ATS 2025年会议上发表的研究显示,Sybil模型在亚洲人群(包括非吸烟者)中表现良好,其1年和6年预测肺癌风险的AUC分别达到0.86和0.74-0.79。这类模型有助于实现个性化的筛查启停年龄和筛查间期。
AI在生物标志物分析中的应用
对于液体活检(如分析复杂的ctDNA测序数据、寻找多标志物组合模式)和呼出气体分析(如识别VOCs谱的特征"指纹")等新兴技术,AI算法是解读其产生的大量、高维复杂数据的关键工具。
AI能够从这些数据中识别出人眼难以察觉的微弱信号、非线性关联和复杂模式,从而提高这些新兴诊断技术的准确性和临床实用性。
AI的优势
提高准确性与一致性:在特定诊断任务中,AI有潜力超越人类专家水平,并减少观察者间的判读差异。
提升效率:AI能够自动化处理重复性、耗时性的任务(如结节检测和测量),缩短阅片时间,缓解医疗资源(尤其是经验丰富的放射科医师)短缺的压力。
优化辐射剂量:在CT成像中,基于AI的图像重建算法可以在保证图像质量的前提下,进一步降低辐射剂量。
AI的局限性与挑战
数据偏倚与泛化能力:AI模型的性能高度依赖于训练数据的质量和代表性。若训练数据存在偏倚(如人群特征、设备型号、扫描参数的局限性),模型在新的、不同特征的数据集或临床环境中的表现可能会显著下降(即泛化能力不足)。
"黑箱"问题与可解释性:许多先进的深度学习模型(尤其是神经网络)的决策过程缺乏透明度,难以解释其为何做出某一特定判断。这种"黑箱"特性可能成为临床医生信任和采纳AI工具的障碍。
模型过拟合:AI模型可能在训练数据上表现优异,但在未见过的新数据上表现不佳,这是模型过拟合训练集特征所致。
临床工作流程整合:将AI工具无缝、高效地整合到现有的医院信息系统(HIS、PACS)和临床工作流程中,面临技术和操作层面的挑战。
特定类型病灶的识别难题:AI在识别某些特殊类型的肺结节(如纯磨玻璃结节(pGGOs)、部分实性结节)或位于复杂解剖结构(如肺门、心后区)的病灶时,仍可能面临挑战。
AI的辅助角色定位:目前,AI更多被视为辅助和增强人类专家能力的工具,而非完全取代放射科医师或其他临床医生。
5. 肺癌筛查的指南推荐
5.1. 主要国际指南概览
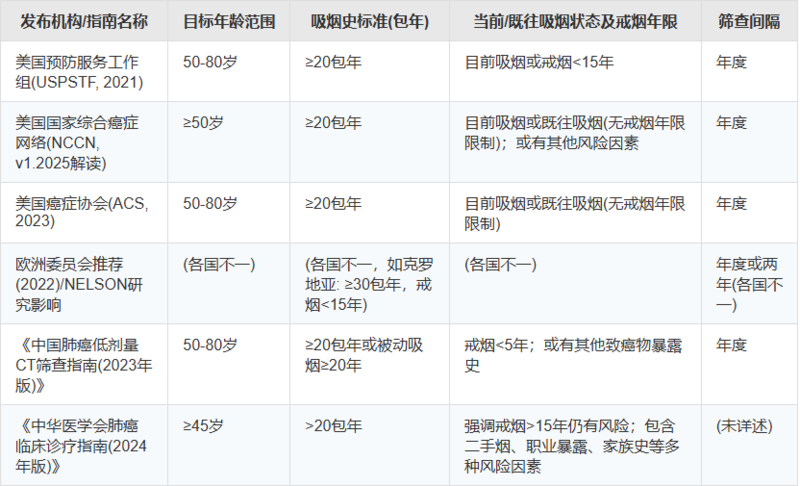
美国预防服务工作组(USPSTF):
推荐对年龄50-80岁,有≥20包年吸烟史,且目前仍在吸烟或戒烟未超过15年(简称A-50-80-20-15规则)的成人进行年度LDCT筛查。此标准为2021年更新,较此前(2013年)的55-80岁、≥30包年有所放宽。
建议在受检者戒烟已满15年、年满81岁,或出现严重健康问题使其预期寿命显著受限或不愿/不能接受可能的肺癌根治性手术时,停止筛查。
美国国家综合癌症网络(NCCN):
在其《NCCN临床实践指南:肺癌筛查》(例如,Version 1.2025的更新解读)中,一个重要的更新是取消了对既往吸烟者戒烟年限(15年)的限制。NCCN推荐对有≥20年吸烟史(注意:部分解读指"吸烟史超过20年",而非严格的"20包年",但主流解读及其他NCCN文献仍强调包年数)的个体进行筛查,无论其戒烟多久。同时,也推荐对年龄≥50岁、有≥20包年吸烟史且合并至少一项其他肺癌风险因素(不包括二手烟)的个体进行筛查。
总体上,NCCN推荐对高危人群进行年度LDCT筛查,起始年龄通常为≥50岁。
美国癌症协会(ACS):
推荐对年龄50-80岁,有≥20包年吸烟史,目前吸烟或既往吸烟者进行年度LDCT筛查。
其2023年指南更新同样取消了对戒烟年限的限制。
强调筛查前的医患共同决策过程和提供戒烟干预的重要性。
欧洲指南:
欧洲委员会于2022年认可了对吸烟者使用LDCT进行肺癌筛查的证据。
各国的具体实施情况不一。克罗地亚是欧洲首个实施全国性人群筛查项目的国家,其标准为:年龄50-75岁,吸烟史≥30包年,戒烟≤15年。
通常推荐年度LDCT筛查,对基于LDCT结果或风险模型评估为较低风险的个体,可考虑2年一次的筛查间期。
考虑使用风险预测模型(如PLCOm2012模型)进行风险分层。
戒烟干预是筛查项目中不可或缺的组成部分。
其他国际组织(如CHEST):
美国胸科医师学会(CHEST)推荐:年龄55-77岁,吸烟史≥30包年,目前吸烟或戒烟≤15年者。
5.2. 中国主要指南概览
中国国家层面指南(基本原则):中国的肺癌筛查指南通常会借鉴国际经验,并结合本国国情,如肺癌发病率高、被动吸烟和环境/职业暴露等特有风险因素的考量。
《中国肺癌低剂量CT筛查指南(2023年版)》:
目标人群:年龄50-80岁;并且满足以下任一条件:吸烟史≥20包年,或被动吸烟≥20年;戒烟时间不超过5年。此外,还包括长期暴露于氡、砷、铍、铬及其化合物、石棉、氯甲醚、二氧化硅、焦炉逸散物和煤烟等肺癌致癌物的个体。
筛查技术与间隔:推荐使用LDCT进行年度筛查。若连续两年年度筛查结果为阴性,可停止筛查。筛查间隔不应超过2年。
《中华医学会肺癌临床诊疗指南》(2024年版;2023年版):
2024年版:继续推荐LDCT用于肺癌筛查。将筛查起始年龄定为45岁。高危因素包括:吸烟量>20包年(并强调即使戒烟超过15年,风险仍高于从不吸烟者)、二手烟或环境油烟吸入史、职业致癌物暴露史、个人肿瘤史、一二级亲属肺癌家族史、慢性肺部疾病史。新版指南还强调了风险模型在肺癌筛查中的应用及其重要性,并提及AI辅助CT读片可能提高肺结节检出率和准确性。
2023年版:推荐年龄≥45岁,采用LDCT年度筛查,吸烟史≥20包年。
《中国肿瘤整合诊治指南(2022年版)》:
目标人群:年龄50-74岁,吸烟史≥20包年,戒烟≤15年。
筛查技术与间隔:LDCT筛查,筛查间隔为2年。
国家癌症中心相关指南:
2018年指南:推荐年龄50-74岁;吸烟史≥20包年,或戒烟≤5年者。采用LDCT年度筛查。同时考虑了特定地区高危因素,如宣威无通风或通风较差的室内燃煤史≥15年;个旧地区有10年或更长坑下作业或冶炼史的个体。
农村癌症早诊早治项目技术方案:对LDCT筛查发现的肺结节,根据其性质(实性、部分实性、非实性)和大小(如实性结节直径≥5 mm,非实性结节直径≥8 mm等作为阳性判断标准)制定了详细的管理和随访原则。
5.3. 共识与分歧领域
共识领域
LDCT是目前国际公认的唯一被证实能有效降低高危人群肺癌死亡率的筛查技术。
肺癌筛查应主要针对经过风险评估确定的高危人群。
戒烟干预是肺癌筛查不可或缺的组成部分,应贯穿筛查全过程。
筛查前的知情同意和医患共同决策至关重要。
分歧与待统一领域
高危人群的具体定义标准:关于筛查的起始与终止年龄、吸烟暴露量(包年数)、戒烟年限等具体阈值,不同国家和机构的指南间存在差异。例如,NCCN和ACS已取消戒烟年限限制,而USPSTF仍保留15年标准。中国指南在戒烟年限上也有不同版本(如5年 vs 15年)。
筛查间期:多数指南推荐年度筛查,但部分欧洲指南和中国肿瘤整合诊治指南提及对特定风险人群可考虑2年筛查间隔。
非吸烟相关风险因素的权重:中国指南相对更明确地将二手烟暴露、职业暴露、环境污染、家族史等非吸烟因素纳入高危人群定义,而西方指南传统上更侧重于吸烟史。
风险预测模型的应用:尽管风险预测模型被认为有潜力优化高危人群筛选,但其在临床实践中的常规应用尚未完全普及,各指南的推荐程度不一。
新兴技术的角色:目前,液体活检、VOCs分析等新兴技术因其在筛查应用中的证据尚不充分,主要被视为未来有潜力的研究方向,尚未被主流指南推荐为常规筛查手段。
表3: 主要肺癌筛查指南推荐概览(主要针对LDCT)
6. 未来方向与创新(2024-2025年展望及更远期)
6.1. LDCT与AI整合的进展
AI驱动的风险分层:开发和验证如Sybil(MIT/哈佛)等AI模型,这些模型能够仅通过单次LDCT扫描预测未来的肺癌风险,甚至可能独立于吸烟史等传统风险因素。在ATS 2025年会议上发表的研究显示,Sybil模型在亚洲人群(包括非吸烟者)中表现出良好的性能,其预测1年和6年肺癌风险的AUC分别达到0.86和0.74-0.79。这可能导致个性化的筛查间隔和决策。
改进的结节管理:AI工具有望更准确地对肺结节进行表征(如区分良恶性、评估生长情况),以减少假阳性并指导后续处理。
6.2. 机器人辅助支气管镜
增强的探查范围和精度:以Ion™内窥镜系统为代表的机器人平台正在改进对肺外周微小结节(这些结节越来越多地被LDCT筛查发现)的探查能力。与传统的导航技术相比,这些系统通常能获得更高的诊断率(已有报道达86-88%)。
更高的安全性:对于外周病灶,机器人辅助支气管镜作为一种微创手段,其并发症发生率(如气胸)可能低于经胸壁穿刺活检。与实时影像(如锥形束CT)的集成进一步提高了操作的准确性和安全性。
未来角色:机器人辅助支气管镜有望成为诊断筛查所发现病灶的关键工具,促进更早期、更准确的诊断。
6.3. 提升液体活检的临床应用价值
提高早期检测的敏感性:
重点发展多标志物组合分析策略(整合ctDNA突变、甲基化、片段组学特征、CTCs、外泌体、蛋白质等)。
推动检测技术的革新,如超高灵敏度的新一代测序(NGS)、数字PCR、以及基于cfDNA片段化模式的分析方法(如DELFI)。
将液体活检数据与影像学(LDCT)和临床风险因素相结合,以增强预测能力。
临床转化与验证:正在进行的大规模前瞻性研究(如DELFI-L201、DELFI-L301等针对cfDNA片段组学的研究)对于验证液体活检在筛查人群中的临床实用性至关重要。检测方法和结果判读的标准化是其广泛应用的前提。
拓展应用场景:除了诊断,液体活检还可用于监测微小残留病(MRD)、早期预警复发等。
6.4. 呼出气体分析(VOCs)技术的成熟化
先进的传感器技术:研发更灵敏、更具选择性、更稳定耐用的传感器阵列(如基于MEMS的气相色谱仪、改进的电子鼻)。
AI与机器学习的深度融合:AI对于解读复杂的VOCs模式("呼吸指纹")至关重要,有望在无需识别每一个单一化合物的情况下提高诊断准确率。一项研究中,K最近邻(KNN)算法分类准确率达到90%。
标准化工作:亟需建立从呼气样本采集、保存、分析到数据处理全流程的标准化操作规程,以确保研究结果的可重复性和可比性。
临床验证:需要在不同人群和真实世界临床环境中进行大规模、多中心的临床试验,以验证有潜力的VOCs特征谱的诊断效能。成本效益分析也是必要的。
6.5. 多组学方法发现新型生物标志物
整合多维度数据:结合基因组学、转录组学(RNA测序、单细胞RNA测序、空间转录组学)、蛋白质组学、代谢组学和表观基因组学数据,以全面理解早期肺癌的发生发展机制。
识别早期分子改变:针对癌前病变和早期浸润癌的多组学研究正在揭示关键的分子事件(如血管生成、免疫微环境改变、特定的突变模式等),这些可能成为早期检测或干预的新靶点。
机器学习整合数据:AI/ML算法对于分析和整合海量、复杂的多组学数据集,以识别稳健的生物标志物组合至关重要。
临床转化:将多组学研究发现的生物标志物转化为临床可用的筛查工具,需要克服数据协调、分析验证、临床效用和成本效益证明等方面的挑战。
6.6. 新型技术临床转化面临的挑战
克服实施障碍:解决在筛查服务的可及性和利用率方面存在的社会经济、文化、操作流程和种族差异问题。提高公众和医务人员的认知,畅通转诊途径。
资源限制:在低收入和中等收入国家(LMICs)推广先进的筛查技术(如LDCT,更不用说更新的技术)面临巨大的成本、基础设施和专业人员短缺的挑战。
假阳性与过度诊断:任何新的筛查方法都必须努力将这些潜在危害降至最低。
监管路径:为新型诊断和筛查测试(尤其是涉及AI或复杂生物标志物的测试)建立清晰、高效的监管审批路径。
7. 结论与战略建议
当前格局与关键技术比较总结
目前,LDCT凭借其在多项大型临床试验中证实的降低高危人群肺癌死亡率的效能,已成为国际公认的肺癌筛查标准手段。然而,其假阳性率高、可能导致过度诊断以及累积辐射暴露等局限性,促使学术界和产业界积极探索更优的筛查策略。传统的CXR和痰液细胞学检查因在降低筛查人群死亡率方面证据不足,已不被推荐用于肺癌筛查。支气管镜检查作为诊断金标准之一,在获取组织病理和分子信息方面不可或缺,其技术(尤其是机器人辅助和导航技术)的进步正不断提升其对早期和外周病变的诊断能力。
以液体活检(ctDNA、CTCs、外泌体等)和呼出气体VOCs分析为代表的新兴技术,因其无创或微创的特性,以及在反映肿瘤生物学特征方面的潜力,被寄予厚望。这些技术在理论上能够更早地捕捉到癌症信号,甚至在影像学改变出现之前。然而,它们在应用于早期筛查时,普遍面临敏感性(尤其是针对极早期病变)、特异性、标准化程度以及大规模临床验证数据不足等挑战。人工智能(AI)作为一种赋能技术,正全面渗透到肺癌早期检测的各个环节,从提升LDCT影像判读的准确性和效率,到辅助解读复杂的生物标志物数据,再到构建精准的个体化风险预测模型,其变革性作用日益凸显。
优化当前筛查策略的建议
持续优化LDCT筛查的适用人群标准:基于不断更新的关于肺癌风险因素(如非吸烟相关因素、不同程度的吸烟暴露、遗传易感性等)的研究证据,以及扩大筛查覆盖面可能带来的获益与风险平衡的考量(例如NCCN指南对戒烟年限的立场调整),动态调整LDCT筛查的纳入与排除标准。
推广AI在LDCT判读中的辅助应用:鼓励医疗机构采纳经过充分验证的AI工具,以辅助放射科医师进行LDCT影像判读,旨在提高结节检出的敏感性和准确性,提升良恶性鉴别的能力,减少阅片者间的差异,提高工作效率,并有望降低假阳性率。
强化戒烟干预在筛查全程的整合:将戒烟咨询和干预服务作为肺癌筛查项目的核心组成部分,对所有参与筛查的吸烟者提供专业的戒烟支持,以期从根本上降低肺癌风险。
完善并推广医患共同决策模式:确保在筛查前,医务人员与潜在受检者就筛查的目的、流程、潜在获益、已知风险(包括假阳性、过度诊断、辐射暴露等)以及不确定性进行充分沟通,帮助受检者做出符合自身价值观和偏好的知情选择。
未来研发重点以推进肺癌早期检测
新兴生物标志物的临床验证与标准化:优先支持开展大规模、多中心、前瞻性的临床试验,以严格评估液体活检(包括ctDNA、CTCs、外泌体及其组合标志物)和呼出气体VOCs分析在不同风险特征人群中用于早期肺癌检测的临床效用(如敏感性、特异性、阳性/阴性预测值)和成本效益。同时,大力推动样本采集、处理、分析检测及数据解读全流程的标准化和质量控制体系建设。
攻克早期病变的检测敏感性瓶颈:集中研发力量,致力于提高液体活检和VOCs分析等技术对I期肺癌乃至癌前病变的检测敏感性。研究方向可包括探索新型、更稳定的生物标志物,开发多组学特征谱(signatures),以及应用更先进的传感器技术和超高灵敏度分析平台。
推动"可信赖AI"的研发与应用:支持开发和验证在准确性、鲁棒性、泛化能力、可解释性和公平性方面均表现优异的AI模型。鼓励研发能够整合多模态数据(影像学、临床信息、分子生物学数据等)的AI算法,以构建更精准、动态的个体化肺癌风险预测模型和筛查决策支持系统。
加强临床转化与实施科学研究:投入资源研究如何有效克服从实验室创新到临床常规应用的转化障碍。这包括进行卫生经济学评估,设计实用的临床整合路径,制定保障公平可及性的策略,以及深入探讨新技术应用可能带来的伦理、法律和社会问题。
聚焦癌症拦截(Cancer IntercEPtion):探索利用超早期检测技术(如高灵敏度分子标志物、AI预测模型等)识别处于癌症发生极高风险状态的个体或已存在癌前病变的患者,为在癌症临床显现前采取预防性干预(如生活方式改变、化学预防、针对癌前病变的治疗等)提供科学依据,最终目标是阻止肺癌的发生或将其扼杀在萌芽状态。
总体战略愿景
肺癌早期检测的未来发展方向应是一个多层面、个性化的综合策略,它将巧妙地整合各种技术的优势,形成一个有序或并行的检测路径。此路径的核心目标是最大程度地早期发现具有临床意义的肺癌,同时最大限度地减少筛查相关的危害(如假阳性、过度诊断)、医疗成本和社会不平等,最终为显著降低全球肺癌疾病负担做出贡献。
关键词: 肺癌筛查、低剂量CT、液体活检、呼气VOCs、人工智能、指南、早期诊断

