韩国食品药物安全处发布全球首份《生成式人工智能医疗器材之许可与审查指引》

韩国食品药物安全处(Ministry of FooD and DrUG Safety, MFDS)于 2025 年 1 月 24 日发布了全球首份《生成式人工智能医疗器材之许可与审查指引》(생성형 인공지능 의료기기 허가·심사 가이드라인)。该指引针对生成式人工智能(GEnAI)医疗器材的特性,明确规范了审查标准与作业程序,内容涵盖适用范围、产品范例、风险管理、申请文件撰写、性能验证及临床有效性确认等项目。
该指引适用于《数位医疗产品法》第 2 条定义,目的为诊断、治疗或预后的 GenAI 医疗器材,涵盖制造、进口许可、认证以及临床试验等面向。对于医疗器材上市后管理、使用者(医疗机构等)的资安管理或不直接影响使用者健康的个人资料外泄等情形,建议遵循《医疗法》与《个人资料保护法》等相关法规。
生成式人工智能医疗器材的判断须依据其使用目的与生成模型的应用方式而定。若产品用途与形式难以明确归类,建议向 MFDS 咨询。属于 GenAI 医疗器材的产品包括:依据胸部 X 光影像自动生成肺部病变报告、依据电子病历(EMR)提供个别化治疗建议、分析语音以早期发现巴金森氏症的工具,以及基因资料风险预测报告软件;单纯用于 EMR 记录与查询,或将语音转为文字病历的工具,则不属于此范畴。
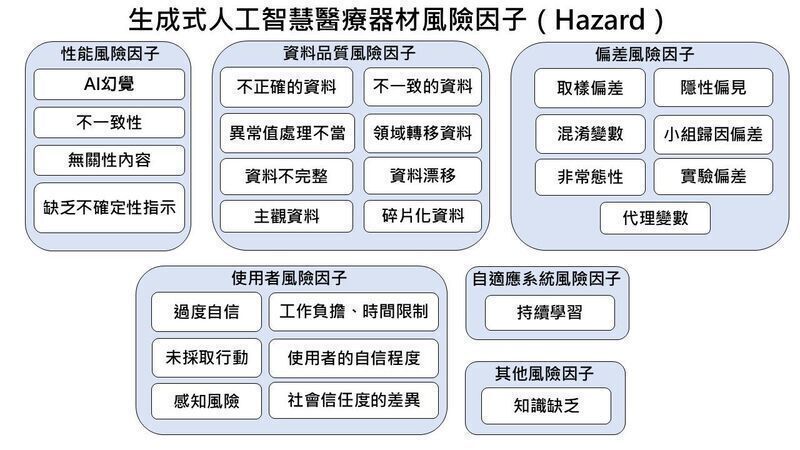
无论是传统医疗器材或 GenAI 医疗器材,都能透过 ISO 14971:2019 的风险管理流程,确认风险是否已降至可接受的范围内。该指引依据 GenAI 医疗器材的特性,提出可能产生的风险因子。制造商可依据产品特性,识别相关风险因子,并采用 ISO 14971:2019 所订程序进行风险管理。
申请者应依照相关规定填写许可申请表,包括名称、产品代码和等级、外观与结构、零组件或构成要素、制造流程、性能(功能)或特性、使用目的、如何使用、使用时注意事项、测试标准、制造商、储存方法和使用期限等项目。
GenAI 医疗器材属于《数位医疗产品法》规定的数位医疗器材软件,须按照相关要求,提交“数位医疗器材软件适合性确认报告”与“软体验证和有效性确认资料”。申请人可依产品特性选用适当指标,评估生成结果的文字一致性与语意相似度。
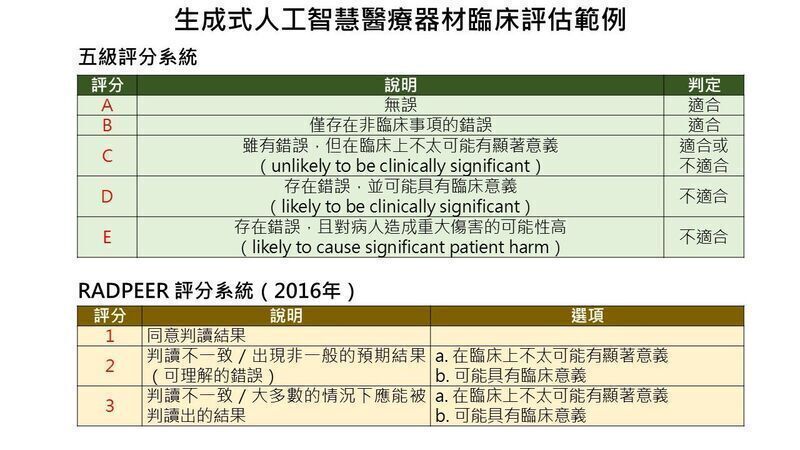
在临床有效性验证部分,指引建议可通过医疗人员进行临床评估或实际临床试验方式,评估生成内容的临床意义与安全性,同时鼓励在产品上市后,持续透过真实世界资料(RWD)建立真实世界证据(RWE),强化长期追踪与风险管理。
韩国食品药物安全处此次发布的《生成式人工智能医疗器材之许可与审查指引》,不仅是全球首份针对 GenAI 医疗器材的专属审查规范,也为各国主管机关提供了一套具体、前瞻且可操作的监管框架。