因 导致33 人受伤,FDA 警示美敦力召回Bravo CF 胶囊
2742025-06-25 11:08:35
美国食品药品监督管理局(FDA)于周二发出警报,通知公众美敦力的 pH 监测胶囊存在问题。该设备用于放置在食管中记录数据,辅助医生诊断胃食管反流糜烂。
受本次通知影响的 Bravo CF 胶囊存在制造缺陷,可能导致其从输送装置上脱落。这可能会使患者面临食管穿孔和吸入性肺炎的严重风险,引发一系列其他并发症,还可能延误诊断。
美敦力及其子公司 Given ImaGing 已向客户发送紧急信函,警告他们停止使用某些批次的胶囊。虽然尚未报告死亡病例,但已知有 33 名患者因该问题受伤。
早期警报和有限召回
此次 FDA 发出通知是其通信试点计划的一部分,旨在使设备召回更加及时和有效。为了合规,必须识别并从供应链中移除某些 BraVo CF 胶囊,无论是在供应商诊所还是经销商库存中。
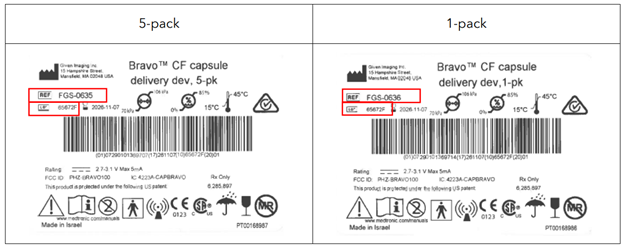
受影响的批次包括以下内容:
| 产品名称 | 产品编号 | UDI-DI |
|---|---|---|
| Bravo CF 胶囊输送装置,5 包装 | FGS-0635 | 07290101369707 |
| Bravo CF 胶囊输送装置,5 包装 | FGS-0635 | 10613994000009 |
| Bravo CF 胶囊输送装置,1 包装 | FGS-0636 | 07290101369714 |
这些信息可以在包装上找到。美敦力已提供图像,帮助匹配受影响的产品编号。
下一步措施
客户应在 6 月 3 日收到美敦力发出的紧急医疗器械召回信。信中指示持有人立即识别具有制造缺陷的 Bravo 胶囊并将其隔离,以免在患者护理中意外使用。
通过联系美敦力客服电话 800-448-3644,按选项 3,可以获取更换或退款。为了从供应链中移除这些设备,公司和 FDA 要求展示并分享此召回通知。
FDA 表示,将继续向公众更新相关问题,以防召回范围扩大到其他批次。完整警报可以在此处找到。