血液制品输注装置召回:费森尤斯卡比(Fresenius Kabi)因组装错误召回大量输注泵血液制品输注装置
本次召回涉及从使用或销售地点移除某些设备。 美国食品药品监督管理局(FDA)已将此次召回确定为最严重的类型。如果继续使用该设备,可能会导致严重伤害或死亡。
受影响产品
| 产品描述 | 部件编号 | UDI-DI | 批号 |
|---|---|---|---|
| 大量输注血液制品输注装置,双入口、低吸附、Y 型接口、滤网 | SET-0014-20 | 20811505030034 | FA24K05015 |
应采取的措施

2025 年 5 月 12 日,费森尤斯卡比向所有受影响的客户发送了一封信,建议采取以下措施:
立即停止使用和分发受影响的产品。检查您的库存,并在您的设施中隔离所有受影响的产品。
通知您组织内潜在的产品使用者此通知内容,并更换为未受影响的产品。
召回原因
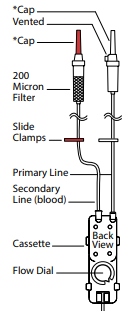
费森尤斯卡比发现特定批次的 IVenix 大量输注血液制品输注装置在组装过程中存在错误。具体来说,主入口和次入口管路在组装时被颠倒,可能导致未经滤网过滤的血液被输注给患者。(见图 1:错误组装)
在正确组装的输注装置中,主入口管路带有白色帽盖,应连接到主入口(“P”);次入口管路(血液)带有红色帽盖,应连接到次入口(“S”)。(见图 2:正确组装)
使用受影响的输注装置可能导致输注未经滤网过滤的血液或治疗延迟,具体取决于患者的情况,可能造成以下危害:
治疗中断和剂量不足:较大颗粒(>约 264 微米)可能阻塞液体通路,触发阻塞警报,并减少输注的血液/血液制品的体积。
未经滤网过滤的血液并发症:未经滤网过滤的血液中的颗粒可能导致异物反应和/或引发肉芽肿(炎症区域)、血栓栓塞(血液凝结和血管阻塞)以及静脉炎(静脉炎症)。除了颗粒外,未经滤网过滤的血液还可能将微生物引入血液,从而导致败血症。儿科患者,尤其是新生儿,因未经滤网过滤的血液导致严重伤害或死亡的风险增加。
低血压和其他并发症:治疗的暂时中断可能导致低血压(低血压)。输注的血栓可能溶解、再通(重新打开阻塞的血管)或扩展(生长和延伸),增加栓塞的风险。
治疗效果降低:临床故障排除(例如,确定问题并获取替代输注装置)可能会延迟及时输血,尤其是在紧急护理环境中尤为关键。
临床结果可能从无症状到严重不良事件不等,特别是在易感人群中,如新生儿、危重病患者或接受大量输血的患者。短期和长期并发症将因患者人群、基础疾病、患者健康状况和治疗方案而异。
截至目前,费森尤斯卡比尚未报告与该问题相关的任何严重伤害或死亡事件。
设备用途
大量输注血液制品输注装置是一种无菌、一次性、可丢弃的输注装置,与 Ivenix 输液系统配合使用,用于输注红细胞、血小板和血浆。Ivenix 输液系统用于医院和门诊护理环境中,通过临床认可的输液途径(静脉、动脉内、硬膜外和皮下)为成人、儿科和新生儿患者提供液体的控制输注。

