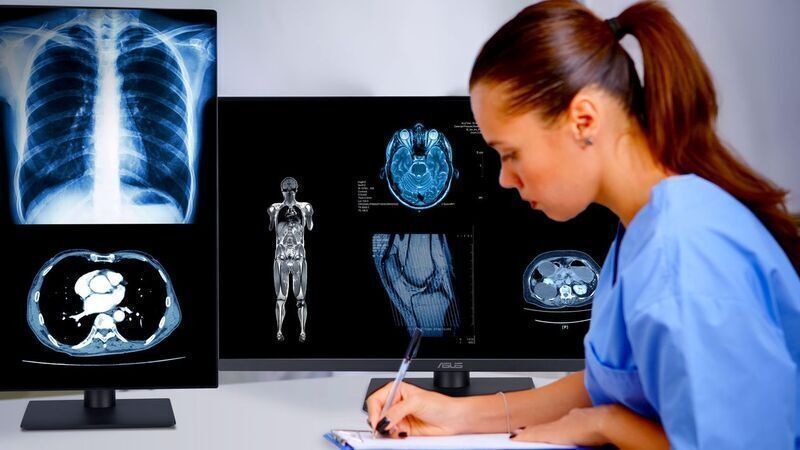
华硕 MH 系列临床显示器获 FDA、TFDA 和欧盟 MDR 列为一类医疗器械
2462025-06-27 12:28:47
华硕近日宣布,其最新的 MH 系列临床显示器已被美国食品药品监督管理局(FDA)、中国台湾地区食品药物管理署(TFDA)和欧盟医疗器械法规(EU MDR)列为一类医疗器械。
华硕 MH 系列临床显示器包括 32 英寸 / 800 万像素的 MH3281A、27 英寸 / 400 万像素的 MH2741A 和 23.8 英寸的 MH2441A。这些显示器专为放射科和影像归档与通信系统(PACS)使用而设计。每台显示器均符合 DICOM PARt 14 灰度标准显示功能(GSDF)AAPM TG270 标准,并具有定时校准功能、动态亮度补偿和动态 DICOM 补偿,以确保医疗图像的一致性和高准确性。此外,每台显示器的面板均具有防眩光、低反射(AGLR)涂层,并且已通过 TÜV Rheinland 认证,确保无闪烁性能和低蓝光排放。这些临床显示器还符合 ISO 13485 要求。
华硕 MH 系列临床显示器实现 FDA、TFDA 和 EU MDR 列名,为每间医院工作空间带来精准的 DICOM 级清晰度和始终开启的校准功能。